July 15, 2025
昌郁医药与神基制药就镇痛新药XG005达成中国独家授权合作

December 12, 2024
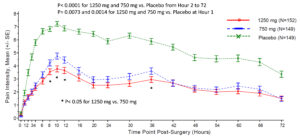
昌郁医药宣布XG005片剂在美国术后疼痛的临床2b/3期试验中取得显著阳性结果

October 25, 2024
昌郁医药骨关节炎临床研究结果被美国风湿病学会(ACR)2024年度大会作为最新摘要接收

August 08, 2024
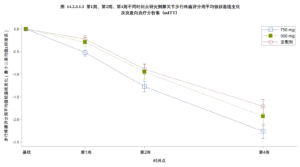
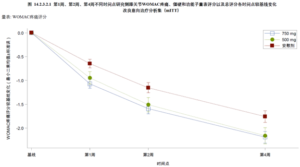
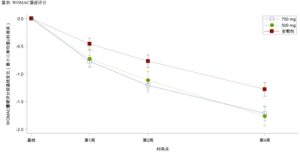
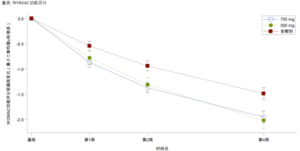
昌郁医药宣布用于治疗骨关节炎疼痛的创新药XG005片剂在2b期临床试验中取得了显著阳性结果

May 08, 2024
昌郁医药选择性TRPM8受体拮抗剂XG2002胶囊I期临床研究首组受试者入组完成

April 08, 2024
昌郁医药宣布XG005中国膝骨关节炎II期临床试验完成目标受试者入组

March 11, 2024
昌郁医药创新镇痛产品XG2002 临床试验获得澳大利亚HREC批准

December 20, 2023
昌郁医药全新靶点镇痛产品XG2002澳大利亚I期临床研究正式启动

August 23, 2023
昌郁医药宣布XG005镇痛在研产品完成在美国的手术后疼痛临床2b/3期试验首例患者入组

April 26, 2023
昌郁医药宣布XG004透皮凝胶治疗膝骨关节炎(OA)疼痛的1b/2a临床试验获得阳性结果

December 22, 2022
昌郁医药首席医学官姜广良博士参加欧洲疼痛临床试验大会并做主题演讲

December 13, 2022
昌郁医药宣布XG005中国II期临床试验完成首例患者入组

November 21, 2022
昌郁医药姜广良博士参加世界疼痛医学大会

July 26, 2022
昌郁医药创新镇痛产品XG004透皮凝胶正式启动澳大利亚1b/2a期临床试验

March 04, 2022
世界知名的疼痛领域创新药研发专家郑国柱博士加入昌郁医药任职首席药物研发官兼高级副总裁(CDO)

November 04, 2021
昌郁医药完成4000万美元C轮超额融资,加速疼痛和神经管线布局

October 04, 2021
姜广良博士加入昌郁医药任职首席医学官(CMO)

September 29,2021
昌郁医药创新镇痛产品XG005 I 期临床桥接试验启动会正式举行

September 22,2021
全球独家!昌郁医药与RaQualia Pharma就全新镇痛产品签署授权协议

April 22,2020
XG005新药上巿的申请,遵循
505(b)(1)法规的监管

May 4, 2019
昌郁医药公司完成B+轮融资

October 25, 2018
昌郁医药公司完成两千万美元 B轮融资